La caquexia es una enfermedad sistémica que se caracteriza por pérdida de peso, atrofia del tejido muscular y adiposo, e inflamación sistémica. Es una de las principales complicaciones y causas de muerte en pacientes con cáncer. Además del cáncer, la caquexia puede ser causada por diversas enfermedades crónicas no malignas, como insuficiencia cardíaca, insuficiencia renal, enfermedad pulmonar obstructiva crónica, enfermedades neurológicas, SIDA y artritis reumatoide. Se estima que la incidencia de caquexia en pacientes con cáncer puede alcanzar entre el 25% y el 70%, lo que afecta gravemente la calidad de vida (CV) de los pacientes y agrava la toxicidad relacionada con el tratamiento.
La intervención eficaz de la caquexia es fundamental para mejorar la calidad de vida y el pronóstico de los pacientes con cáncer. Sin embargo, a pesar de algunos avances en el estudio de los mecanismos fisiopatológicos de la caquexia, muchos fármacos desarrollados basándose en posibles mecanismos solo son parcialmente eficaces o ineficaces. Actualmente, no existe ningún tratamiento eficaz aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).
Existen numerosas razones para el fracaso de los ensayos clínicos sobre caquexia, y la principal podría residir en la falta de un conocimiento profundo de su mecanismo y evolución natural. Recientemente, el profesor Xiao Ruiping y el investigador Hu Xinli, de la Facultad de Tecnología del Futuro de la Universidad de Pekín, publicaron conjuntamente un artículo en Nature Metabolism, que revela el importante papel de la vía láctica-GPR81 en la aparición de caquexia por cáncer, aportando así una nueva perspectiva para su tratamiento. Resumimos este artículo mediante la síntesis de artículos de Nat Metab, Science, Nat Rev Clin Oncol y otras revistas.
La pérdida de peso suele deberse a una menor ingesta de alimentos o a un mayor gasto energético. Estudios previos han sugerido que estos cambios fisiológicos en la caquexia asociada a tumores son impulsados por ciertas citocinas secretadas por el microambiente tumoral. Por ejemplo, factores como el factor de diferenciación del crecimiento 15 (GDF15), la lipocalina-2 y la proteína similar a la insulina 3 (INSL3) pueden inhibir la ingesta de alimentos al unirse a sitios reguladores del apetito en el sistema nervioso central, lo que provoca anorexia en los pacientes. La IL-6, la PTHrP, la activina A y otros factores impulsan la pérdida de peso y la atrofia tisular al activar la vía catabólica y aumentar el gasto energético. Actualmente, la investigación sobre el mecanismo de la caquexia se ha centrado principalmente en estas proteínas secretadas, y pocos estudios han analizado la asociación entre los metabolitos tumorales y la caquexia. El profesor Xiao Ruiping y el investigador Hu Xinli han adoptado un nuevo enfoque para revelar el importante mecanismo de la caquexia relacionada con tumores desde la perspectiva de los metabolitos tumorales.
En primer lugar, el equipo del profesor Xiao Ruiping analizó miles de metabolitos en la sangre de controles sanos y ratones modelo de caquexia por cáncer de pulmón, y descubrió que el ácido láctico era el metabolito con mayor elevación en los ratones con caquexia. El nivel sérico de ácido láctico aumentó con el crecimiento del tumor y mostró una fuerte correlación con el cambio de peso en los ratones con tumores. Las muestras de suero obtenidas de pacientes con cáncer de pulmón confirman que el ácido láctico también desempeña un papel clave en la progresión de la caquexia por cáncer en humanos.
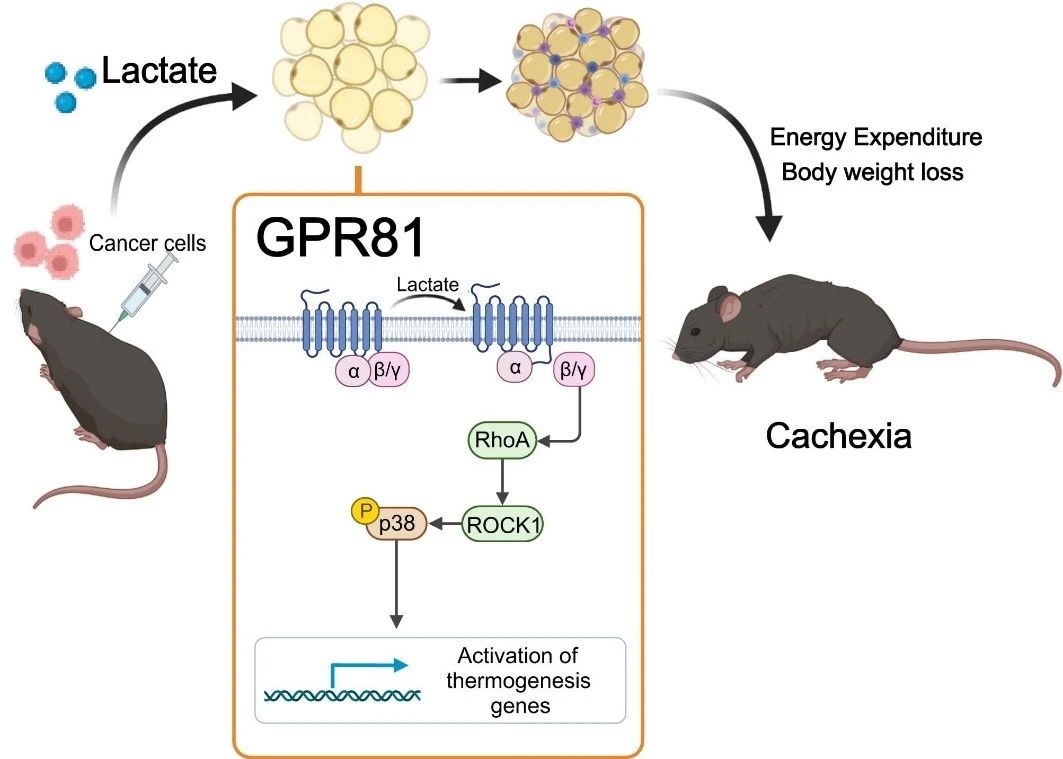
Para determinar si los niveles elevados de ácido láctico causan caquexia, el equipo de investigación administró ácido láctico a la sangre de ratones sanos mediante una bomba osmótica implantada bajo la piel, elevando artificialmente los niveles séricos de ácido láctico hasta alcanzar el nivel de los ratones con caquexia. Tras dos semanas, los ratones desarrollaron un fenotipo típico de caquexia, como pérdida de peso y atrofia del tejido adiposo y muscular. Estos resultados sugieren que la remodelación grasa inducida por el lactato es similar a la inducida por las células cancerosas. El lactato no solo es un metabolito característico de la caquexia por cáncer, sino también un mediador clave del fenotipo hipercatabólico inducido por el cáncer.
Posteriormente, descubrieron que la eliminación del receptor de lactato GPR81 era eficaz para aliviar las manifestaciones de caquexia inducida por el tumor y el lactato sérico, sin afectar los niveles séricos de lactato. Dado que GPR81 se expresa en gran medida en el tejido adiposo y que este se modifica antes que el músculo esquelético durante el desarrollo de la caquexia, el efecto de inactivación específica de GPR81 en el tejido adiposo de ratones es similar al de la inactivación sistémica, mejorando la pérdida de peso inducida por el tumor y el consumo de grasa y músculo esquelético. Esto sugiere que la presencia de GPR81 en el tejido adiposo es necesaria para el desarrollo de la caquexia cancerosa inducida por ácido láctico.
Estudios posteriores confirmaron que después de unirse a GPR81, las moléculas de ácido láctico impulsan el Browning graso, la lipólisis y el aumento de la producción de calor sistémico a través de la vía de señalización Gβγ-RhoA/ROCK1-p38, en lugar de la vía PKA clásica.
A pesar de los prometedores resultados en la patogénesis de la caquexia relacionada con el cáncer, estos hallazgos aún no se han traducido en tratamientos eficaces, por lo que actualmente no existen estándares de tratamiento para estos pacientes. Sin embargo, algunas sociedades, como la ESMO y la Sociedad Europea de Nutrición Clínica y Metabolismo, han desarrollado guías clínicas. Actualmente, las guías internacionales recomiendan encarecidamente promover el metabolismo y reducir el catabolismo mediante estrategias como la nutrición, el ejercicio y la medicación.
Hora de publicación: 28 de abril de 2024